29 июня состоялась долгожданная встреча представителей Росздравнадзора и компании “Шир”, выпускающей лекарство “Элапраз” для больных синдромом Хантера. Английская компания уже полгода пытается зарегистрироваться на российском рынке, чтобы больные могли купить лекарство, однако пока процесс не сдвинулся с мертвой точки. Есть надежда, что эта встреча положит начало продуктивной работе.
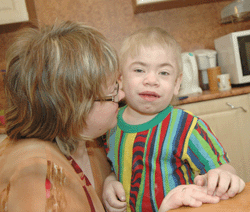
Напомним, что без препарата “Элапраз” Павлик Митин
(на фото с мамой) и другие дети, больные мукополисахаридозом, могут умереть (“Солидарность” писала об этом в № 23, 2007).
На встрече Андрей Младенцев, замруководителя Росздравнадзора, сказал, что рад видеть представителей “Шир” и готов к сотрудничеству, но только с условием строжайшего соблюдения законодательства. Ханс Флод, региональный директор “Шира”, подтвердил, что компания хочет работать только по закону, с соблюдением всех норм и требований: тут стремления двух сторон едины. Желание работать строго в соответствии с действующим законодательством иллюстрируется и открытием официального представительства фармацевтической компании Shire Human Genetic Therapies Inc. в Москве, в Смоленском пассаже 27 августа 2007 года.
Представителям “Шир” обрисовали порядок процедуры регистрации препарата, рассказали об этапах, о предрегистрационной подготовке пакета документов, выдали распечатки соответствующих законов, рассказали о требованиях к клиническим испытаниям препарата. Специалисты Росздравнадзора рассказали о научной работе, проводимой в нашей стране в области исследования генетических заболеваний.
Учитывая тяжесть состояния некоторых пациентов с синдромом Хантера, Ханс Флод просил о получении разрешения на ускоренную регистрацию с проведением клинических испытаний. Росздравнадзор подтвердил такую возможность, и на сегодняшний момент от имени компании “Шир” написаны письма в Минздравсоцразвития и Росздрав с ходатайствами.
Из-за крайней нежелательности, а то и невозможности для пациента прерывания лечения (при определенном состоянии пациента), Диана Шутсбах, управляющий директор компании “Шир”, поинтересовалась вопросом финансирования лечения “Элапразом”. Ольга Соловьева, специалист Росздравнадзора, пояснила, что федеральное агентство осуществляет только контроль и надзор в сфере здравоохранения за качеством, порядком, регламентом, проведением лечения и клинических испытаний, а вопросами финансирования занимаются специальные структуры и ведомства (Горздрав, Минздравсоцразвития). Включение препарата “Элапраз” в список дополнительного лекарственного обеспечения также не является функцией Росздравнадзора. Этим занимаются в Миздравсоцразвития, куда врачи вправе обратиться с такой просьбой. Но сделать это можно будет только после официального завершения процедуры регистрации препарата.
Англичане надеются, что в ближайшее время их препарат попадет на российский рынок и поможет больным детям. А “Солидарность” все еще ждет ответа на официальный запрос в Росздравнадзор.
Юлия РЫЖЕНКОВА

Чтобы оставить комментарий войдите или зарегистрируйтесь на сайте